Componentes de la tabla periódica
- mari90felix98
- 9 jun 2018
- 8 Min. de lectura
Actualizado: 22 jun 2018
Periodos, grupos o familias.
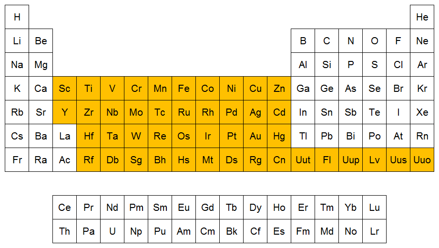
Periodos, grupos o familias.- las filas horizontales en la tabla periódica se llaman periodos y en total hay 7 periodos y las columnas verticales se llaman grupos y en total hay 18 grupos. Estos grupos están divididos en sub grupos A y B Los subgrupos A debido a sus similitudes dentro del grupo son llamados a menudo familias.
Algunas de estas familias llevan nombres especiales tal como es el caso de:
Los metales alcalinos para el grupo IA., metales alcalinos Térreos para el grupo IIA Halógenos para el grupo VIIA, los otros grupos son algunas veces clasificados de acuerdo al primer miembro del subgrupo o familia. Así los elementos del subgrupo IIIA, algunas veces son llamados la familia del Boro, los elementos del subgrupo IVA como la familia del carbono, los elementos de subgrupo VA como la familia del Nitrógeno, los elementos del subgrupo VIA como la familia del Oxigeno. El último grupo llamado cero o en algunas veces llamado grupo VIIIA, contiene una serie de elementos con una configuración muy estables conocidos como Gases Nobles. Estos elementos tienen muy poca tendencia a reaccionar con otros. Por esta razón originalmente fueron denominados gases inertes (puesto que ellos son gases a temperatura ordinaria). Hoy sabemos que ellos reaccionan en condiciones apropiadas, aunque las condiciones son un poco drásticas. Por esta razón son llamados gases nobles. El término gas noble implica que estos elementos tienden a existir por ellos mismos o sea en estado libre.
CLASES DE ELEMENTOS.- Así como han sido clasificados los elementos en metales y no metales, los elementos también pueden dividirse en cuatro clases a saber: elementos representativos, gases nobles, elementos de transición y elementos de transición interna.
Clases de elementos en la tabla periódica en donde se localiza las 4 clases de elementos de los subgrupos A y B.
Elementos Representativos.- Los elementos representativos son los subgrupos A - IA hasta VI IA. En estos elementos. El nivel de energía más externa está incompleto y los electrones están ocupando los orbitales S o P, al pasar de un elemento representativo al próximo. Por tanto la configuración electrónica para estos elementos será desde ns1, np5 por ejemplo:
11Na (sódio) 1s2, 2s2, 2p6, 3s1.
Gases Nobles.- Los gases nobles forman el último grupo en la tabla. Cada elemento de este grupo tienen el conjunto de orbitales S y P completamente llenos, así la configuración electrónica para los electrones más externos en cada caso es PS (con excepción del helio). Esta es una configuración electrónica aparentemente muy estable por ejemplo la configuración electrónica para el Neón es la siguiente:
10 Ne 1s2, 2s2, 2p6.
Elementos de Transición.- Los elementos de transición son las series en las cuales un conjunto de orbitales d, está lleno. En general el nivel de energía más externo tendrá una configuración de ns, (exceptuando los grupos VIB y IB). Además se presenta la configuración (n-1) d1 hasta (n-1) d10. Por ejemplo la configuración electrónica para el Níquel es la siguiente
28 Ni ls2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d8.
Elementos de transición Interna.- Las series de transición interna son las 2 series de los elementos desde el 58(Cesio Ce), hasta el 71 (Lutecio Lu), y desde 90 hasta el 103 en los cuales se esta llenando un conjunto de orbitales f. Algunas veces estas son llamadas series de transición largas. En general estos elementos tienen 3 niveles de energía incompletos ya que un electrón entra en un orbital d antes que el conjunto de los orbitales f empiece a llenarse, en consideración esta serie de transición interna se les conoce como Lantánidos y Actínidos, por ejemplo tenemos la configuración electrónica para el Uranio que es la siguiente:
92U 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6, 7s2,5f3,6d1.
Atomo: es la porción más pequeña de cualquier elemento químico, que no puede dividirse y que dispone de existencia independiente. Los átomos están compuestos por electrones que orbitan en torno a un núcleo con neutrones y protones.
Simbolo Quimico: La química, por su parte, es la ciencia que analiza la materia, estudiando sus características, estructura y composición. Los cambios que desarrolla la materia durante las denominadas reacciones químicas también forman parte de su objeto de estudio.
Nombre del elemento: solo es el nombre asignado a este
Masa Atomica: Se conoce como masa atómica a la masa que posee un átomo mientras éste permanece en reposo. En otras palabras, puede decirse que la masa atómica es aquella que surge de la totalidad de masa de los protones y neutrones pertenecientes a un único átomo en estado de reposo. Dentro del Sistema Internacional, la unidad que permite calcularla y reflejarla es la masa atómica unificada.
COMPONENTES DE LA TABLA PERIÓDICA
Las propiedades periódicas de los elementos químicos, son características propias de dichos elementos que varían de acuerdo a su posición en la tabla periódica, ósea dependiendo de su número atómico.Las propiedades periódicas son: electronegativo, electropositividad, radio atómico, afinidad electrónica, potencial de ionización, la densidad atómica, el volumen atómico, temperatura de fusión y temperatura de ebullición.
Aunque las cuatro ultimas propiedades mencionadas muchas veces son consideradas aperiódicasLas propiedades mayormente estudiadas son.
ElectronegatividadLa es la tendencia que un átomo tiene para atraer hacia el los electrones cuando forma un enlace químico.La electronegatividad tiene la particularidad de no poder ser dimensionada directamente por lo que necesita de otro tipo de cálculos basados en otras propiedades atómicas o moleculares para ser determinada.La escala de Pauling es una muestra fiel del ejemplo anteriormente mencionado, en ella se define que la electronegatividad crece en la familia de abajo hacia arriba, debido a la disminución del radio atómico y del aumento de intercesiones del núcleo con la electrosfera.En mención al concepto antes vertido y para determinarlo de forma práctica podemos apreciar que el fluór es el elemento más electronegativo de la tabla periódica. ElectropositividadLa forma de medir la electropositividad es exactamente igual que la utilizada para las mediciones inherentes a su homónimo, mediante un enlace químico.Entretanto la tendencia dentro de la tabla de elementos es contraria, ya que mide la tendencia de un átomo en perder electrones: Un claro ejemplo son los metales los cuales son los mas electropositivos de la tabla.La electropositivitad crece en el sentido opuesto a la electronegatividad. De arriba hacia abajo esto nos demuestra que es el Francio anteriormente denominado eka-cesio y actinio K, simbolizado por Fr y de numero atómico 87 el mas electropositivo de la tabla
Es importante considerar, que los gases nobles son demasiado inertes, por lo que el estudio de los valores de electronegatividad y electropositividad no es objeto de estudio debido a la complejidad que involucra la obtención de los datos.Radio atómico.Cuando nos referimos a radio atómico, básicamente planteamos la posibilidad de medir la distancia entre el núcleo de un átomo y la nube de electrones que componen su capa externa.Las técnicas existentes en la actualidad que permiten generar resultados, son por ejemplo la difracción de neutrones, de electrones o de rayos X, en todo caso es necesario recalcar que no es una propiedad fácil de medir, ya que depende entre otras muchas variables de la especie química en la que se encuentre el átomo.También es necesario aclarar que existen dos medidas que se pueden tomar dependiendo el caso, podemos obtener radios atómicos covalentes o metálicos, en el caso de los radios covalentes nos referimos a la distancia entre los núcleos de átomos vecinos en moléculas.
El radio metálico corresponde a la mitad de la distancia entre ambos núcleos lo que marcaría la pauta del tamaño del radio comprendido entre el núcleo del citado átomo y su capa de valencia.El radio atómico en la familia de los elementos aumenta de arriba hacia abajo, acompañada proporcionalmente de la cantidad de átomos de cada elemento, a mayor valor en numero atómico de un elemento, mayores son las fuerzas ejercidas entre el núcleo y la electrosfera, lo que se resume en un menor radio atómico.Por lo tanto y como nos indica la tabla el elemento de mayor radio atómico es el Cesio.Afinidad Electrónica
La afiniadad electrónica se basa en la medición de la energía liberada por un átomo en estado fundamental y no en estado gaseoso al recibir un electrón.Además es la energía mínima necesaria para la liberación de un electrón perteneciente a un anión de un determinado elemento.Los gases nobles no presentan afinidad electrónica relevante, aunque es importante recalcar que nunca igual a 0, la adición de electrones siempre genera liberación de energía.La afinidad electrónica no presenta una forma muy definida dentro de la tabla periódica aunque su comportamiento es similar al de la electronegatividad, por lo tanto la veremos crecer de abajo hacia arriba de izquierda a derecha.El Cloro como ejemplo claro posee la mayor afinidad electrónica de la tabla cerca de 350 KJ/mol Potencial de Ionización.
El potencial de ionización mide lo inverso a la afinidad electrónica, por lo tanto podemos decir que mida la energía necesaria para retirar un electrón de un átomo neutro en estado fundamental.Considerando que la energía necesaria para retirar el primer electrón siempre es mayor que la necesaria para retirar el segundo electro que a su vez es menor que la tercera y así sucesivamente.Presenta el mismo comportamiento que la afinidad electrónica y la electronegatividad.Por lo tanto podemos deducir que el Flúor y el Cloro son los elementos con mayores potenciales de ionización ya que son los elementos de mayor afinidad electrónica de la tabla periódica.Las técnicas existentes en la actualidad que permiten generar resultados, son por ejemplo la difracción de neutrones, de electrones o de rayos X, en todo caso es necesario recalcar que no es una propiedad fácil de medir, ya que depende entre otras muchas variables de la especie química en la que se encuentre el átomo.También es necesario aclarar que existen dos medidas que se pueden tomar dependiendo el caso, podemos obtener radios atómicos covalentes o metálicos, en el caso de los radios covalentes nos referimos a la distancia entre los núcleos de átomos vecinos en moléculas.El radio metálico corresponde a la mitad de la distancia entre ambos núcleos lo que marcaría la pauta del tamaño del radio comprendido entre el núcleo del citado átomo y su capa de valencia.El radio atómico en la familia de los elementos aumenta de arriba hacia abajo, acompañada proporcionalmente de la cantidad de átomos de cada elemento, a mayor valor en numero atómico de un elemento, mayores son las fuerzas ejercidas entre el núcleo y la electrosfera, lo que se resume en un menor radio atómico.Por lo tanto y como nos indica la tabla el elemento de mayor radio atómico es el Cesio.
Afinidad ElectrónicaLa afiniadad electrónica se basa en la medición de la energía liberada por un átomo en estado fundamental y no en estado gaseoso al recibir un electrón.Además es la energía mínima necesaria para la liberación de un electrón perteneciente a un anión de un determinado elemento.Los gases nobles no presentan afinidad electrónica relevante, aunque es importante recalcar que nunca igual a 0, la adición de electrones siempre genera liberación de energía.La afinidad electrónica no presenta una forma muy definida dentro de la tabla periódica aunque su comportamiento es similar al de la electronegatividad, por lo tanto la veremos crecer de abajo hacia arriba de izquierda a derecha.El Cloro como ejemplo claro posee la mayor afinidad electrónica de la tabla cerca de 350 KJ/molPotencial de IonizaciónEl potencial de ionización mide lo inverso a la afinidad electrónica, por lo tanto podemos decir que mida la energía necesaria para retirar un electrón de un átomo neutro en estado fundamental.Considerando que la energía necesaria para retirar el primer electrón siempre es mayor que la necesaria para retirar el segundo electro que a su vez es menor que la tercera y así sucesivamente.Presenta el mismo comportamiento que la afinidad electrónica y la electronegatividad.Por lo tanto podemos deducir que el Flúor y el Cloro son los elementos con mayores potenciales de ionización ya que son los elementos de mayor afinidad electrónica de la tabla periódica.












Comentarios